Cálculo del número de oxidación
Para determinar el número de oxidación de un elemento en una especie química cualquiera,
debemos tener en cuenta las siguientes reglas:
• Los átomos de los elementos que no forman parte de un compuesto
químico tienen número de oxidación cero, 0, incluso
cuando forman moléculas o estructuras poliatómicas, como
N2, hierro...
• El número de oxidación de un ion monoatómico es su propia
carga; así, Na+ tiene un número de oxidación de +1 y Cl−, −1.
• El oxígeno emplea comúnmente el número de oxidación −2.
• El hidrógeno utiliza habitualmente el número de oxidación +1.
Solo en los hidruros utiliza el número de oxidación −1.
• La suma algebraica de todos los números de oxidación de los
átomos que intervienen en la fórmula de una sustancia neutra
En los iones poliatómicos esta suma debe ser igual a la carga
total, positiva o negativa, del ion.
Puesto que el oxígeno y el hidrógeno forman parte de muchos compuestos,
la asignación de sus números de oxidación permite determinar
el número de oxidación de los otros elementos del compuesto
4.4. Compuestos binarios
La unión de solamente dos átomos de dos elementos forman un compuesto binario. Pueden
haber distintos tipos de compuestos binarios dependiendo de la reacción que ocurra
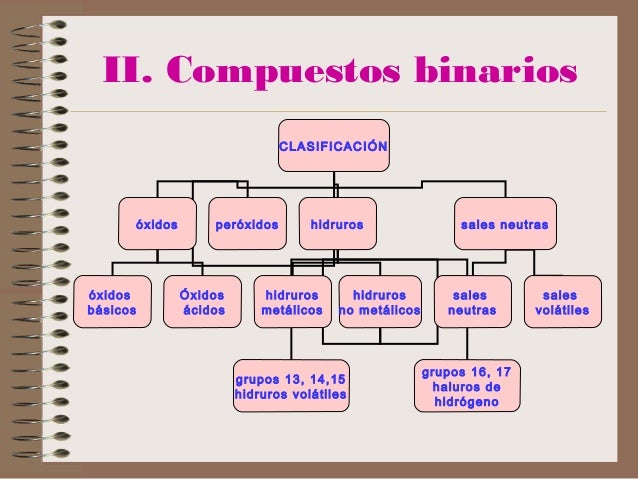
Formulación de los compuestos binarios
Si el compuesto está formado por un elemento metálico y otro no metálico, el metal
se coloca siempre a la izquierda. Y si está formado por dos elementos no metálicos,
se coloca a la izquierda del elemento queaparece antes en la siguiente lista:
B, Si, C, Sb, As, P, N, H, Te
Escribimos los números de oxidación de cada elemento por ejemplo: M+3 X-2
Asignamos a cada elemento el subíndice necesario para que la suma total de los números
de oxidación sea cero.
Para efectuar esta suma, asignamos a cada elemento el subíndice necesario para que la
suma total de los números de oxidación sea cero.
Para efectuar esta suma, multiplicamos cada número de oxidación por el número de átomos
del elemento en cuestión que contiene la fórmula. A continuación, sumamos todos los
resultados obtenidos:
M2
+3 X3
-2 2. (+3) + 3 × (-2) = 0
Escribimos la fórmula definitiva, en la que no deben apareces ni los números de oxidación
ni los subíndices 1:
M2 X3
4.5. Compuestos ternarios y cuaternarios
Como su nombre lo indica un compuesto ternario va a estar formado por tres elementos.
Mientras que un compuesto cuaternario estará constituido por cuatro elementos. Pueden
existir tres tipos de compuestos ternarios y tres tipos de compuestos cuaternarios.
No hay comentarios:
Publicar un comentario