Función sal
Llamamos sales a los compuestos que son el resultado de la unión de un catión cualquiera con un anión distinto de H+,OH− y O2-.
La mayoría de las combinaciones binarias de un metal con un no metal son sales. Así tenemos, por ejemplo, el clorurode sodio y el sulfuro de potasio.
NaCl contiene el catión Na+ y el anión Cl−
K2S contiene el catión K+ y el anión S2-
Sales halógenas neutras
Estos compuestos resultan de la combinación entre metales y no metales de las familias VI y
VII por la neutralización total de los hidrogeniones del ácido y los oxidrilos de la base.
Na(OH )- + HCl NaCl + H2O
hidróxido ácido cloruro de
Solido clorhídrico sodio agua
En la reacción química apreciamos que los dos iones se unen formando una molécula de
agua y lo que queda es el compuesto salino llamado cloruro de sodio.
Para comprender mejor vamos a desarrollar la siguiente fórmula.
Ca(OH)2 + 2HCl CaCl2 + H2O
hidróxido de calcio ácido clorhídrico cloruro de calcio agua
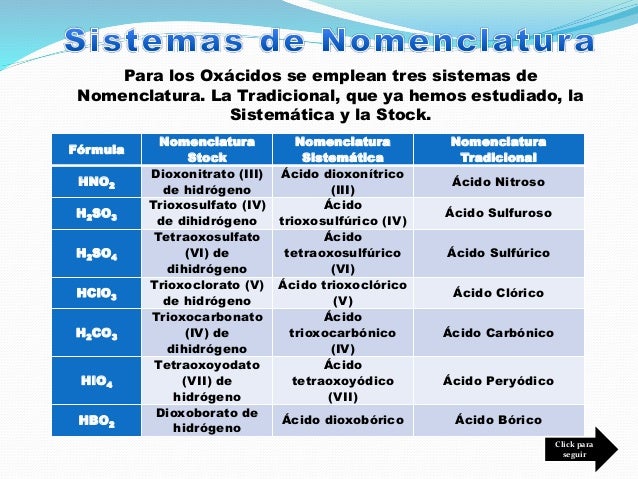
Nomenclatura
• Tradicional: El nombre del no metal con la terminación uro, seguido del nombre del
metal. Si tiene más de una valencia oso para el menor e ico para el mayor. Ejemplo:
bromuro cobaltoso, yoduro tálico.
• Stock: El nombre del no metal terminado en uro más el nombre del metal, y en paréntesis
la valencia en números romanos. Ejemplo: bromuro de cobalto (II), yoduro de talio (II).
• Sistemática: Utilizando los prefijos momo- di- tetra- etc., seguido del nombre del no metal
con la terminación uro y el nombre del metal. ej. Dibromuro de monocobalto, diyoduro
de monotalio.
Oxisales neutras
Formulación: Primero escribimos el símbolo del metal seguido del ion poliatómico, posteriormente
intercambiamos las valencias. Ejemplos: Na2CO3 carbonato de sodio, Fe(ClO3)3
clorato de hierro (III).
Nomenclatura
• Tradicional: El nombre del ácido cambiando la terminación -oso por -ito e -ico por -ato,
seguido del nombre del metal. Si este tiene valencia variable la terminación será -oso
o -ico. Ejemplo: carbonato de sodio, clorato férrico.
• Stock: Colocamos el término oxo, precedido de los prefijos cuantitativos, luego el nombre
del ion poliatómico terminado en -ito o -ato seguido del nombre del metal y la valencia
de éste entre paréntesis. Ejemplos: Trioxocarbonato de sodio (I), trioxoclorato de
hierro (III).
• Sistemática: Colocamos el término oxo, precedido de los prefijos cuantitativos, el nombre
del ion poliatómico terminado en -ato para todos los casos, seguido del nombre
del metal con los prefijos cuantitativos. Ejemplo: trioxocarbonato de disodio, trioxoclorato
de monohierro.
Sales ácidas
A estas sales las obtenemos por la neutralización parcial de los H+ del ácido y los OH- de la base o hidróxido o por la sustitución parcial de los hidrógenos de los ácidos por cationes metálicos.
Una de las sales ácidas más utilizadas es el cloruro de amonio.
El cual se produce mediante la siguiente reacción:
HCl + NH3 → NH4Cl
El cloruro de amonio se usa como:
1. Diurético, actúa aumentando la excreción renal
2. Acidificante
3. Reactivo para la fabricación de pilas secas y para el
galvanizado.
Sales halógenas ácidas
En este caso para formar la sal emplearemos un ácido
hidrácido y una base.

Formulación: Escribimos el símbolo del metal seguido del hidrógeno y posteriormente el no
metal.
Nomenclatura
• Tradicional: sulfuro ácido de sodio
• Stock: hidrógeno sulfuro de sodio (I)
• Sistemática: monohidrógeno monosulfuro de sodio
Oxisales ácidas
Son semejantes a las ácidas halógenas, pero, en este caso, empleamos iones poliatómicos
provenientes del oxoácido, los hidrógenos libres pasan a formar parte de la sal.+
Formulación:
Primero anotamos el símbolo del metal, seguido del hidrógeno y posteriormente el ion
poliatómico.
Nomenclatura
• Tradicional: Fosfato ácido de litio
• Stock: Dihidrógenofosfato de litio (I)
• Sistemática: Dihidrógeno monofosfato de litio
Aplicaciones:
Se usan en la medicina, industria alimenticia y en la
fabricación de productos de limpieza
Sales básicas
Estas sales son similares a las ácidas, pero en lugar de quedar libres los H+, sobran los OH-, en
otras palabras la neutralización es parcial y quedan libres los iones oxidrilos. Hay dos clases
de estas sales, las halógenas básicas y las oxisales básicas.
Formulación: El símbolo del metal seguido del grupo hidroxilo y después el no metal.
Nomenclatura
• Tradicional: Cloruro dibásico de aluminio
• Stock: Hidróxi cloruro de aluminio
• Sistemática: Dihidroxi cloruro de aluminio
Sales oxisales básicas
Aquí utilizamos los iones poliatómicos.

Formulación: El símbolo del metal seguido del grupo hidroxilo y después el ion poliatómico.
Nomenclatura
• Tradicional: Nitrato básico de calcio
• Stock: Hidróxi trioxonitrato de calcio
• Sistemática: Hidroxi nitrato de calcio